医薬品情報管理学[1]
土曜日, 1月 26th, 2008医薬品情報21
古泉秀夫
| 医薬品情報とは |
1]情報とは何か
断片的なものを収集し、連続させることによって、一つあるいは複数の意味を持つものに変化する流れである。
また、意味を持つ一つ一つの断片が、集積されることによって、大きな意味を持つ物語に変換する過程であるとすることも出来る。
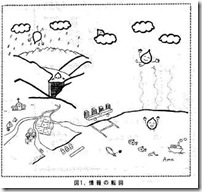
言ってみれば、山に降った雨が、散り積もった腐葉土に染みこみ、一定の年限を経て小さな流れとなり、やがて大河となる。その流れ出る水が情報であり、一定のルールに従い、人に役立つように利用するとともに、暴走して大洪水とならないよう管理すること、これが情報の管理であるということが出来る。
河川の護岸工事をし、水源を造って水を溜める。その水を発電用に使用するのかあるいは農業用水にするのか、飲料用水にするのかの使途による再度細流を作る。情報管理とは、用水の管理をするのと同じ作業であるとすることが出来る。
従って、医薬品情報管理を考える場合、その基本となるのはあくまで総合的な情報管理の技術であって、医薬品情報に限定した情報管理技術はない。言ってみれば総合的な情報の水源から流れ出た細流の一つを固定して管理しているということに過ぎないのである。
その意味では、医薬品情報管理学の入門書として、特別なものを考えるのではなく、一般的な情報管理に関係する入門書を読むことを推奨する。参考図書として、次の図書を紹介する。
?梅棹忠夫:知的生産の技術;岩波新書,1969
?加藤秀俊:整理学;中公新書,1963
?川勝 久:新整理学;ダイアモンド社,1985
?河野徳吉:情報整理術;日本経済新聞社,1977
?加藤秀俊:情報行動;中公新書,1972
?加藤秀俊:取材学;中公新書,1975
?野口悠紀夫:「超」整理法;中公新書,1993
なお、これらの図書を読む場合、初読時に必要と思われる事項に黄色の蛍光マーカーでマークし、再読時に必要と感じた事項に別の色でマークするという方式を取ると、視点の変化が明瞭になるばかりでなく、重要と思われる事項は二重にマークされることになるので、後で参照する必要が生じた場合に、必要事項の検索が容易になる。
この方式は、文献等の抄録を作成するための訓練、key wordを選定するための訓練としても重要であり、key word選定目的の場合には、最初に1文献当たりの必要key word数を決定し、作業にかかることが必要である。
2]医薬品とは何か
専門職能である薬剤師に対して『医薬品とは何か?』等と質問するのは、甚だ失礼であるの謗りを受けるかもしれないが、既に御承知の通り、薬事法第二条に、医薬品に関する法律上の定義がされている(図2)。
図2.医薬品とは
|
*薬事法上の定義(第二条)
? 日本薬局方に収められている物。 |
しかし、医薬品情報管理学の立場から見た医薬品は、この法律の定義とは若干異なった見方が必要となってくる。
図3.医薬品情報管理学から見た医薬品
医薬品原料として使用される物として、鉱物・生物成分・植物成分・動物成分・魚類を含む海産物成分等、多くの物質が考えられる。これらの成分を医薬品とすべく、最初に開始されるのが『基礎的研究』である。
勿論、従来、我が国で行われてきた漢方薬による治療では、植物・鉱物・動物等の原体を、そのまま粉末化して服用するか、浸煎剤等として、医薬品としての使用がされてきたが、現在では、それらに含有される成分を単離することによって、より有効・安全な薬物の創製が追求されている。
『基礎的研究』の結果を受け、更に健康人による『第I相臨床試験』において人における安全性等の検討がされ、『第II相前期臨床試験』・『第II相後期臨床試験』において、少数の患者群による安全性・有効性・至適投与量等の確認が行われた上で、本格的な医薬品としての『第III相臨床試験』へと展開していく。
患者を対象とした臨床試験は、『GCP(Good Clinical Practice)」による規制がされている。
つまり『臨床試験成績の信頼性確保』のために『科学的に』、『適正な実施』することが求められており、更に臨床試験結果の信頼性・患者の人権擁護の立場から『説明された上での自由な同意(Informed consent)』を求めるべく、実施する医療機関が遵守すべき事項が厳しく定められている。
これらの開発期間は、その『物』に対する『医薬品』としての情報集積期間であり、各種臨床試験の総合的な結果を受けて、医薬品としての製造承認がされる。つまり医薬品とは、『物』に付加価値としての『情報』が付け加えられることによって『医薬品』として承認される物であり、薬剤師が医薬品の管理を行うということは、これらの情報管理も含めて、管理を行うということなのである。
また発売後の医薬品についても、PMSにより、現在、発売後6年間の副作用調査が義務付けられており、患者の安全確保を図るべく努力がされているが、これも本質的には、安全に医薬品を使用するための情報の集積業務である。
従って、薬剤師の業務として、『医薬品情報管理業務』は至極当たり前の業務であり、情報量の増加が『情報管理業務』を独立化・専門化させているのである。その意味では全ての医療機関に、医薬品情報管理室及び管理のための専門家が配置されていないことが、問題であるといわなければならない。
[東京都病院薬剤師会会誌,44(3):161-163(1995.6.30.)以降に連載]